BactoSonic
Ultraschall-Spezialbad zur schonenden Abl├Čsung von Biofilmen

Kompakt & Leistungsstark
Kleines Ultraschallbad f├╝r gro├¤e Anwendungen
SweepTec
zur st├żndigen Schallfeldoszillation f├╝r gleichm├ż├¤ige Beschallung
Robust
Das robuste Edelstahlgeh├żuse ist pflegeleicht und tropfwassergesch├╝tzt
Leistungseinstellung
von 20% bis 100%
geringe Itensit├żt, hohe Homogenit├żt
Zeit, Temperatur, Leistung und somit Anpassung an den jeweiligen Probenk├Črper
F├╝llstandsmarkierung
zur sicheren und genauen Bef├╝llung des Ger├żtes
Wirkprinzip des BactoSonic
Das Implantat wird in die Fl├╝ssigkeit der entsprechenden Box gelegt und in dem f├╝r dieses Verfahren speziell entwickelte BactoSonic Ultraschallbad sonifiziert. Dieses Ger├żt arbeitet im Vergleich zu anderen Ultraschallb├żdern mit niederfrequentem Ultraschall bei geringer Intensit├żt und hoher Homogenit├żt. Ziel ist die Entfernung des Biofilms, ohne die Bakterien zu zerst├Čren, die f├╝r die nachfolgende Analyse erhalten bleiben m├╝ssen. Die erhaltene Fl├╝ssigkeit wird mikrobiologisch verarbeitet und die Bakterienmenge quantitativ angegeben. Es k├Čnnen bis zu 10.000-mal mehr Bakterien nachgewiesen werden als mit ├╝blichen Methoden, wie zum Beispiel aus Biopsien von periprothetischem Gewebe. Mischinfektionen und unterschiedliche Bakterien-Morphotype k├Čnnen besser nachgewiesen werden. Die Sensitivit├żt ist insbesondere bei Patienten mit vorangegangener Antibiotikatherapie verbessert.
Technische Details finden Sie im Datenblatt.
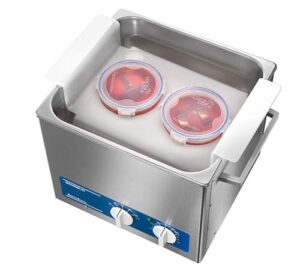
Betriebsfertiges Set – Best.-Nr. 3291
BactoSonic 14.2
Implantate und Infektion
Mit zunehmender Verwendung medizinischer Implantate sind wir auch vermehrt mit infekti├Čsen Biofilmen auf diesen konfrontiert. Zu den h├żufigsten Implantaten geh├Čren Gelenkprothesen, Osteosynthesen, vaskul├żre Prothesen, Pacemaker und Defibrillatoren, Zahnimplantate, neurochirurgische Shunts und Brustimplantate.
Der Therapieerfolg bei Implantatinfektionen ist abh├żngig von einer
pr├żzisen, mikrobiologischen Diagnose. Weil Mikroorganismen auf
Fremdk├Črpern Biofilme bilden, sind sie aber oft schwierig in umgebendem
Gewebe nachzuweisen.
Biofilme bestehen aus einer amorphen Matrix aus
polymerisiertem Polysaccharid, in welcher Mikroorganismen eingebettet
sind. Im Biofilm befinden sich Mikroorganismen in einer metabolisch
wenig aktiven, station├żren Wachstumsphase. ├£ber Wochen bis Jahre
entwickelt sich eine komplexe dreidimensionale Schicht, die ├╝ber
rudiment├żre Strukturen die Ern├żhrung des Biofilmes (├╝ber Wasserkan├żle)
und seine Kommunikation (durch extrazellul├żre Botenstoffe)
gew├żhrleistet.
W├żrend frei lebende (planktonische) Bakterien von Antibiotika und dem Immunsystem abget├Čtet werden, ├╝berleben adh├żrente Bakterien gesch├╝tzt in der extra zellul├żren Matrix des Biofilms.


Nachweis von Biofilm-bildenden Bakterien
Das Implantat wird aseptisch im Operationssaal aus dem K├Črper entfernt und in einer sterilen Box innerhalb von 24 Stunden in das Mikrobiologielabor transportiert. Nach Zusatz von Ringerl├Čsung wird das Implantat kr├żftig gesch├╝ttelt und f├╝r 1 Minute dem Ultraschall ausgesetzt. Dabei entfernt die Sonikation > 99,9% der adh├żrenten Bakterien.
Quantitativer Nachweis Biofilm-bildender Bakterien


Nachweis von Biofilm-bildenden Bakterien
verschiedene
Implantatboxen

Bandelin Electronic
Qualit├żt seit 1955
Wir ŌĆō ein Berliner Familienunternehmen in dritter Generation ŌĆō sind spezialisiert auf die Entwicklung, Herstellung und den Vertrieb von Ultraschallger├żten, entsprechendem Zubeh├Čr sowie anwendungsspezifischen Reinigungs- und Desinfektionspr├żparaten. Die hohe Fertigungstiefe, eine moderne Produktionsst├żtte und motivierte Mitarbeiter zeichnen uns aus und sind Garanten f├╝r st├żndig neue Qualit├żtsprodukte.











